À l’occasion de la première expédition d’échantillonnage entièrement menée par le programme ATLASea, de nouveaux spécimens marins ont été récoltés dans le long de la côte autour de Dinard, ville bretonne située sur la Côte d’Émeraude.


À gauche, Plage de la Pointe de la Roche Pelée, Dinard. À droite, la station Marine du Muséum d’Histoire naturelle, Dinard. © ATLASea
Du 24 juin au 6 juillet, la station marine du Muséum national d’Histoire naturelle à Dinard a été témoin d’une grande effervescence scientifique. Plus de 60 participants, dont une quinzaine de taxonomistes et trois photographes, ont investi les lieux pour faire partie de la première expédition d’échantillonnage entièrement menée par le programme ATLASea.
Accueillies et aidées par une vingtaine de personnels travaillant dans cette station, les équipes ont réalisé un travail remarquable tout en ayant un rythme très soutenu. Au total, 472 espèces marines ont été collectées et envoyées au Genoscope à Évry pour réaliser le séquençage de leur génome.
Certains membres des équipes d’ATLASea avaient déjà réalisé quelques mois auparavant des missions d’échantillonnage pilotes en Nouvelle-Calédonie et en Méditerranée, ce qui avait permis de roder la chaîne logistique (récolte, identification et conditionnement des échantillons). Désormais, ils ont pu appliquer leurs protocoles en traitant une quantité d’espèces plus importante.
La récolte
Afin de récolter les spécimens bretons, une grande variété de moyens a été mise à disposition : Le Bleiz-Mor et l’Émeraude Explore, des bateaux semi-rigides ont été utilisés pour escorter des plongeurs au large de la Côte d’Émeraude, mais aussi dans les ports alentours, pour faire des récoltes à vue en eaux profondes.


À gauche, Michel Le Gall sur un bateau semi-rigide. À droite, la directrice du projet ciblé DIVE-Sea, Line Le Gall, équipée d’un recycleur, un appareil de plongée qui offre une plus grande autonomie d’utilisation. © ATLASea
Le Louis Fage, un chalutier de la station marine, quant à lui, se rendait régulièrement à la sortie du port de Saint-Malo, une zone riche en sédiments. À l’aide de filets, d’une drague et d’une benne à sédiments, les marins à bord prélevaient de la vase, des algues, des coquilles et du sable fin, là où vivent les petits spécimens.
« Dans certains types de sédiments, qui sont très hétérogènes, avec énormément d’anfractuosité, on peut retrouver une centaine d’espèces dans un prélèvement de moins d’un mètre carré. C’est une biodiversité qui est énorme » indique Sébastien Aubin, chargé d’étude à la station marine de Dinard.
De retour à la station, les sédiments récoltés devaient être tamisés pour séparer les spécimens de leur substrat et les trier en fonction de leur taille. Dernière étape, les attraper avec délicatesse et dextérité, car certains spécimens nageaient à toute vitesse comme les amphipodes.


Paillasse de tri à la station marine du MNHN à Dinard. © ATLASea
En parallèle, certains participants se sont aventurés en bord de mer, pour y collecter d’autres types de spécimens, notamment des poissons. Une première pour le programme ATLASea qui n’avait pas encore intégré ces vertébrés dans leur plan de collecte.


À gauche, Marie Sémon, professeure à l’ENS Lyon en visite au site de la Dame de Jouanne à Saint-Briac-sur-Mer et à droite Cécile Bernard, directrice de la recherche au MNHN et deux stagiaires, Charli Rossi-Burden et Flora Roest Crollius. © ATLASea


Alexandre Carpentier, maître de conférence, spécialiste en écologie fonctionnelle des relations poissons-habitats sur le continuum terre-mer à la plage Saint-Enogat à Dinard. © ATLASea
L’identification
Pendant la phase d’identification des spécimens, la proximité entre les taxonomistes et les biologistes du Genoscope a grandement facilité la reconnaissance des espèces. Ils ont pu savoir rapidement quel était leur sexe et leur anatomie pour déterminer quels étaient les tissus organiques avec la plus haute concentration d’ADN.
De plus, des workshops, animés par les taxonomistes, ont été organisés de manière inédite. Ainsi, les participants ont pu apprendre à identifier les ascidies, les algues, les annélides, les crustacés, les mollusques, les éponges et les bryozoaires, les poissons et élasmobranches, mais aussi sur les biocénoses et les habitats benthiques.


À gauche, Riccardo Virgili, ingénieur de l’Université de Naples. À droite, une annélide au microscope. © ATLASea
Le conditionnement
Après avoir vérifié que le spécimen identifié n’était pas dans les bases de données existantes et l’avoir soigneusement photographié grâce à de nouveaux appareils très performants, les biologistes du Genoscope devaient faire vite : sélectionner, nettoyer et mettre en tube les meilleurs échantillons avant de les plonger dans de l’azote liquide afin de les congeler instantanément.
En attendant d’être envoyés au Genoscope les petits tubes d’échantillons, munis d’un code barre d’identification, étaient stockés dans un congélateur à – 80 °C. Il y avait pour chaque espèce 3 cryotubes d’échantillons au minimum et 10 s’il y avait suffisamment d’échantillons.



À gauche, étiquetage des tubes d’échantillons. Au milieu, intégration des caractéristiques de l’espèce dans la trame, la base de données qui regroupe toutes les espèces à séquencer. À droite, ouverture d’une cuve d’azote liquide. © ATLASea
Les défis
Bientôt, les biologistes du Genoscope seront confrontés à de nombreux défis : parmi eux, il faudra séquencer les échantillons de spécimens de moins de 100 mg. En effet, pour séquencer correctement un spécimen, il faut une quantité de tissus suffisamment élevée, avec une concentration d’ADN importante, et pour l’instant les protocoles nécessitent au moins cette quantité de tissus.
Aussi, un autre défi sera d’extraire l’ADN des algues. En effet, dans le milieu où elles vivent, c’est-à-dire à faible profondeur pour avoir accès à la lumière et près des côtes pour se fixer sur un substrat rocheux, l’hydrodynamique, autrement dit la houle, est souvent très forte. Les algues pour absorber cette énergie font preuve de souplesse et elles ont donc développé toute une diversité de polysaccharides, une classe de glucides complexes, dans leur paroi cellulaire qui leur confère flexibilité et leur aspect glissant et visqueux. Or, selon Line Le Gall, directrice du projet ciblé DIVE-Sea et spécialiste des algues, « ces polysaccharides ressemblent beaucoup à l’ADN et sont souvent co-extrait avec ce dernier », ce qui complique grandement les traitements en aval de l’extraction.
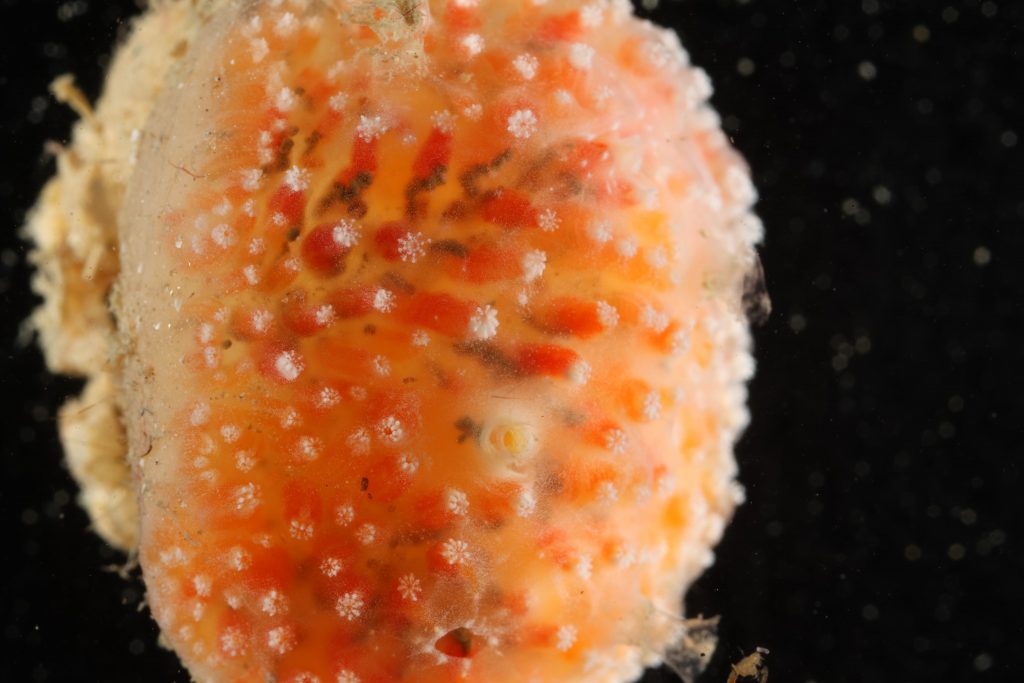
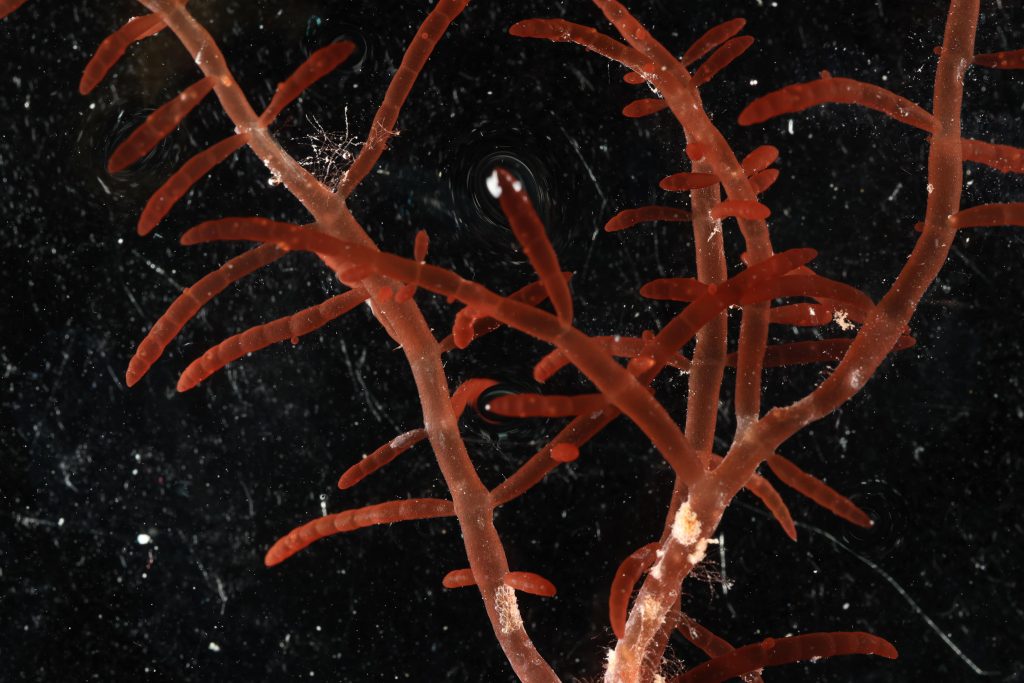
D’autres espèces seront tout aussi difficiles à séquencer. En attendant, en voici une sélection collectée pendant cette mission.